Terapia con fagos para vencer la resistencia a los antibióticos
En experimentos prometedores, la terapia con fagos obliga a las bacterias a enfrentarse a un dilema sin salida que reduce sus defensas contra los fármacos que habían evolucionado para resistir.
15 septiembre 2024.- En 1910, el microbiólogo francocanadiense Félix d'Hérelle observó a través de su microscopio algunas "manchas claras" en sus cultivos bacterianos, una anomalía que resultó ser virus que atacaban a las bacterias. Años más tarde, d'Hérelle utilizaría estos virus, a los que llamó bacteriófagos , para tratar a pacientes afectados de disentería después de la Primera Guerra Mundial.
En las décadas siguientes, d'Hérelle y otros utilizaron esta terapia con fagos para tratar la peste bubónica y otras infecciones bacterianas hasta que la técnica cayó en desuso después de la adopción generalizada de antibióticos en la década de 1940.
Pero ahora, con las bacterias desarrollando resistencia a cada vez más antibióticos, la terapia con fagos está siendo objeto de una nueva mirada por parte de los investigadores, a veces con un giro novedoso. En lugar de simplemente utilizar los fagos para matar bacterias directamente, la nueva estrategia apunta a atrapar a las bacterias en un dilema evolutivo: uno en el que no pueden evadir fagos y antibióticos simultáneamente.
Este plan, que utiliza algo llamado “manejo de fagos”, ha mostrado resultados prometedores en pruebas iniciales, pero aún queda por demostrar el alcance de su utilidad.

Felix d'Hérelle en su laboratorio del Instituto Pasteur de París. Fue pionero en el uso de bacteriófagos para tratar infecciones bacterianas justo después de la Primera Guerra Mundial. CRÉDITO: INSTITUT PASTEUR / ARCHIVOS
Sin duda, es necesario encontrar nuevas formas de responder a las infecciones bacterianas. Más del 70 por ciento de las infecciones bacterianas adquiridas en hospitales en los Estados Unidos son resistentes a al menos un tipo de antibiótico. Y algunos patógenos, como Acinetobacter , Pseudomonas, Escherichia coli y Klebsiella, clasificados por la Organización Mundial de la Salud como algunas de las mayores amenazas para la salud humana , son resistentes a múltiples antibióticos . En 2019, la resistencia a los antibacterianos se relacionó con 4,95 millones de muertes en todo el mundo , lo que aumenta el llamado a opciones de tratamiento más efectivas.
Una de las formas en que las bacterias pueden desarrollar resistencia a los antibióticos es mediante el uso de estructuras en sus membranas diseñadas para expulsar las moléculas no deseadas de la célula. Al modificar estas “bombas de eflujo” para que reconozcan el antibiótico, las bacterias pueden eliminar el fármaco antes de que las envenene.
Resulta que algunos fagos parecen utilizar estas mismas bombas de eflujo para invadir la célula bacteriana. El fago presumiblemente adhiere su cola a la parte exterior de la proteína de la bomba, como una llave que se desliza en una cerradura, y luego inyecta su material genético en la célula. Esta afortunada coincidencia llevó a Paul Turner, un biólogo evolutivo de la Universidad de Yale, a sugerir que tratar a un paciente con fagos y antibióticos simultáneamente podría atrapar a las bacterias en una situación sin salida: si evolucionan para modificar sus bombas de eflujo de modo que el fago no pueda unirse, las bombas ya no expulsarán antibióticos y las bacterias perderán su resistencia. Pero si conservan su resistencia a los antibióticos, los fagos las matarán , como explicaron Turner y sus colegas en la Revisión anual de virología de 2023 .
En otras palabras, el resultado es un ataque en dos frentes. Es como un efecto entrecruzado. El mismo principio puede dirigirse a otras moléculas bacterianas que desempeñan un papel doble en la resistencia a los virus y a los antibióticos.
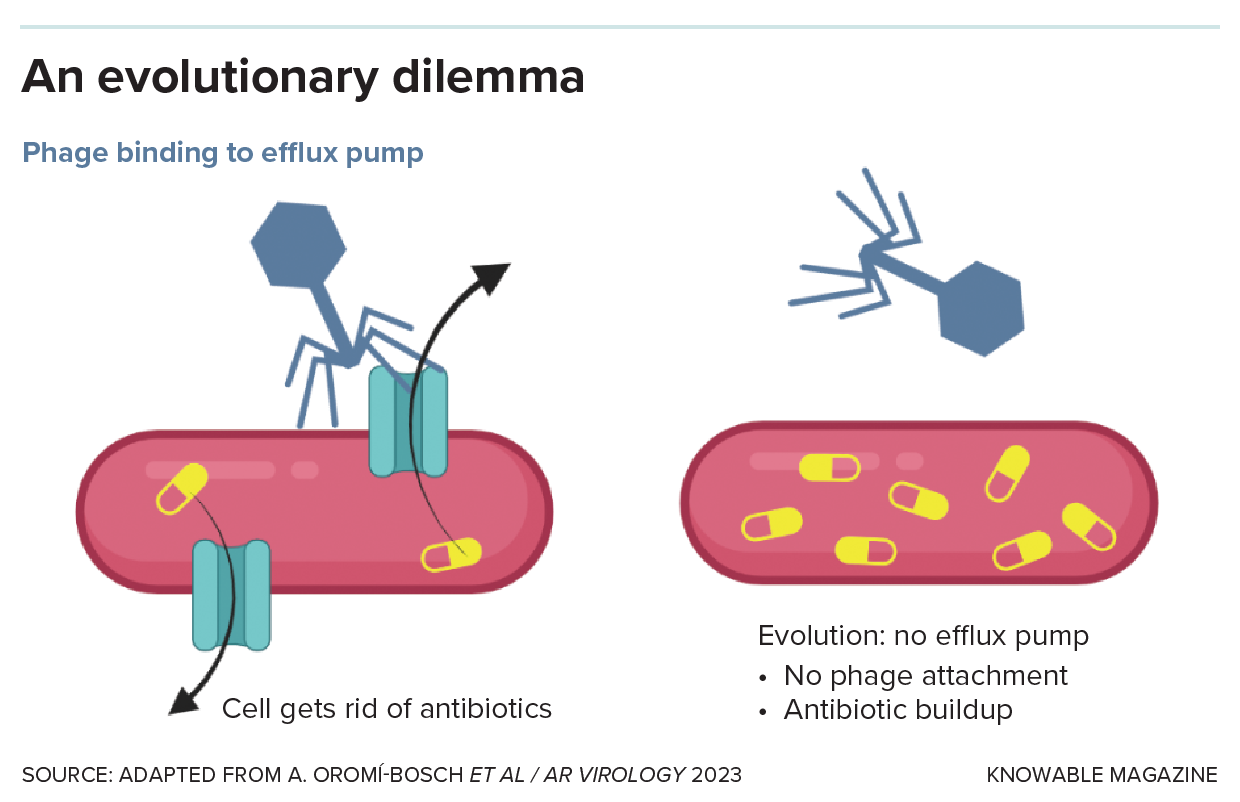
Algunos bacteriófagos se adhieren a las células bacterianas (el primer paso para invadirlas) utilizando las mismas moléculas de la superficie celular, conocidas como bombas de eflujo, que hacen que las bacterias sean resistentes a los antibióticos. Los fagos obligan a las bacterias a enfrentarse a un dilema evolutivo: si conservan las bombas de eflujo, los fagos entrarán y las matarán, pero si evolucionan para perder las bombas de eflujo y evadir a los virus, los antibióticos las matarán.
Turner puso a prueba esta hipótesis en Pseudomonas aeruginosa , resistente a múltiples fármacos y que causa infecciones peligrosas, especialmente en entornos sanitarios. Esta bacteria tiene cuatro bombas de eflujo implicadas en la resistencia a los antibióticos, y Turner predijo que si pudiera encontrar un fago que utilizara una de las bombas como forma de entrar en la célula, la bacteria se vería obligada a cerrarle la puerta al fago mutando el receptor, impidiendo así su capacidad de bombear antibióticos.
El equipo de Turner tomó muestras del entorno y recolectó 42 cepas de fagos que infectan a P. aeruginosa. De todos los fagos, uno, OMKO1, se unió a una bomba de eflujo, lo que lo convirtió en el candidato perfecto para el experimento.
Los investigadores cultivaron entonces P. aeruginosa resistente a los antibióticos junto con OMKO1, con la esperanza de que esto obligara a la bacteria a modificar su bomba de eflujo para resistir al fago. Expusieron estas bacterias resistentes al fago, así como sus contrapartes normales, sensibles al fago, a cuatro antibióticos a los que las bacterias habían sido resistentes: tetraciclina, eritromicina, ciprofloxacino y ceftazidima.
Como predecía la teoría, las bacterias que habían desarrollado resistencia al fago eran más sensibles a los antibióticos que las que no habían estado expuestas a él. Esto sugiere que, en efecto, las bacterias se habían visto obligadas a perder su resistencia a los antibióticos debido a su necesidad de luchar contra el fago.
Otros investigadores también han demostrado que la manipulación de fagos puede volver a sensibilizar a las bacterias a los antibióticos comunes a los que se habían vuelto resistentes. Un estudio, realizado por un equipo de investigación internacional, demostró que un fago llamado Phab24 puede utilizarse para restaurar la sensibilidad al antibiótico colistina en Acinetobacter baumannii , que causa enfermedades potencialmente mortales.
En un segundo estudio, investigadores de la Universidad de Monash en Australia tomaron muestras de bacterias infecciosas de pacientes. Descubrieron que varios fagos, incluidas las cepas conocidas como ΦFG02 y ΦCO01, ya estaban presentes en algunas de las muestras, y que las bacterias A. baumannii expuestas a los fagos habían inactivado un gen que ayuda a crear la importante capa externa del microbio, o cápsula. Esta capa sirve como punto de entrada para los fagos, pero también ayuda a la bacteria a formar biopelículas que impiden el paso de los antibióticos, por lo que la eliminación de la capa hizo que A. baumannii fuera susceptible a varios antibióticos a los que anteriormente era resistente.
En un tercer estudio, investigadores de la Universidad de Liverpool descubrieron que cuando una cepa de P. aeruginosa resistente a todos los antibióticos se exponía a fagos, la bacteria se volvía sensible a dos antibióticos que de otro modo se consideraban ineficaces contra P. aeruginosa.
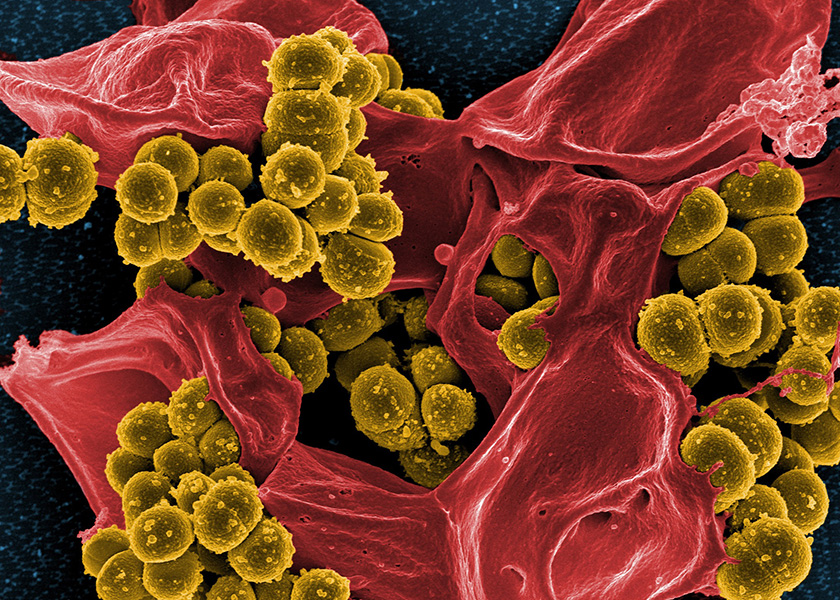
La resistencia a los antibióticos es un problema creciente. Esta fotografía muestra un Staphylococcus aureus resistente a la meticilina (amarillo), uno de los patógenos resistentes más graves, y un glóbulo blanco humano muerto (rojo). Los investigadores han tenido cierto éxito en revertir la resistencia a los antibióticos al tratar a los pacientes infectados con bacteriófagos específicos. CRÉDITO: INSTITUTO NACIONAL DE ALERGIA Y ENFERMEDADES INFECCIOSAS (NIAID) / NIH
El equipo de Turner ha utilizado la técnica de control de fagos en docenas de casos de terapia personalizada en entornos clínicos, afirma Benjamin Chan, un microbiólogo de la Universidad de Yale que trabaja con Turner. Los resultados, muchos de ellos todavía no publicados, han sido prometedores hasta ahora. Las infecciones no respiratorias son relativamente fáciles de eliminar, y las infecciones pulmonares, que no se esperaría que el método de control de fagos erradicara por completo, a menudo muestran cierta mejoría. Pero a veces es difícil determinar si la técnica de control de fagos fue realmente la responsable de las curas.
El diablo está en los detalles
La terapia con fagos puede no funcionar para todas las bacterias resistentes a los antibióticos. Esto se debe a que los fagos son muy específicos del huésped y, en el caso de la mayoría de ellos, nadie sabe a qué diana se unen en la superficie de la célula bacteriana. Para que la terapia con fagos funcione contra la resistencia a los antibióticos, el fago tiene que unirse a una molécula que esté implicada en esa resistencia, y no está claro con qué frecuencia ocurre esa coincidencia fortuita.
Jason Gill, que estudia la biología de los bacteriófagos en la Universidad Texas A&M, afirma que no es fácil predecir si un fago provocará sensibilidad a los antibióticos, por lo que siempre hay que buscar el virus adecuado en cada caso.
Gill sabe por experiencia lo complicado que puede llegar a ser este enfoque. Formó parte de un equipo de investigadores y médicos que utilizaron fagos para tratar a un paciente con una infección por A. baumannii resistente a múltiples fármacos . Menos de cuatro días después de que el equipo le administrara fagos por vía intravenosa y a través de la piel, el paciente despertó del coma y comenzó a responder al antibiótico minociclina, que hasta entonces no había sido eficaz: un éxito sorprendente.
Pero cuando Gill intentó un experimento similar en cultivos celulares, obtuvo un resultado diferente. El A. baumannii desarrolló resistencia a los fagos, pero también mantuvo su resistencia a la minociclina. “No existe una comprensión completa del mecanismo”, dice Gill. “El vínculo entre la resistencia a los fagos y la sensibilidad a los antibióticos probablemente varía según la cepa bacteriana, el fago y el antibiótico”. Eso significa que la dirección de los fagos puede no siempre funcionar.
Turner, por su parte, señala otro problema potencial: que los fagos podrían funcionar demasiado bien. Si la terapia con fagos mata grandes cantidades de bacterias y deposita sus restos en el torrente sanguíneo rápidamente, por ejemplo, esto podría provocar un shock séptico en los pacientes. Los científicos aún no saben cómo abordar este problema.
Otra preocupación es que los médicos tienen un control menos preciso sobre los fagos que sobre los antibióticos. Los fagos pueden mutar, pueden adaptarse, tienen un genoma propio. Las preocupaciones por la seguridad, señala, son un factor que inhibe el uso rutinario de la terapia con fagos en países como Estados Unidos, restringiéndola a aplicaciones caso por caso.
La terapia con fagos puede haber sido demasiado sofisticada para la década de 1940, y aún hoy los científicos luchan por encontrar la manera de utilizarla. Lo que necesitamos ahora, dice Turner, son experimentos rigurosos que nos enseñen cómo hacerla funcionar.
Fuente: Knowable magazine


















COMENTARIOS