medicamentos, salud, vida saludable, obesidad
Los medicamentos contra la obesidad de próxima generación funcionarán de manera diferente a Ozempic y Wegovy, y apuntarán a lograr una mayor pérdida de peso con menos efectos secundarios
12 febrero 2025.- La pérdida de masa muscular es una gran preocupación para las personas que toman medicamentos contra la obesidad, como la semaglutida. Estos "agonistas del GLP-1" imitan una hormona intestinal natural (el péptido similar al glucagón 1) para suprimir el apetito y regular el metabolismo. Pero la reducción de calorías conduce a un déficit de energía, que el cuerpo suele compensar quemando músculo. El fármaco experimental, llamado bimagrumab, parece contrarrestar esta pérdida de masa muscular.
Es uno de los más de 100 fármacos candidatos contra la obesidad que se encuentran en diversas etapas de desarrollo. La próxima ola de medicamentos , que probablemente llegará a las farmacias en los próximos años, se parece a los medicamentos que ya están en el mercado. Pero muy de cerca hay numerosas terapias que se están desarrollando específicamente por su potencial para perder peso sin afectar a los músculos. Decenas de otras están dirigidas a diferentes vías biológicas y podrían redefinir el tratamiento de la obesidad en las próximas décadas .
"Estamos trabajando para crear la próxima generación de soluciones saludables para perder peso", dice Philip Larsen, quien jugó un papel clave en el desarrollo inicial de los medicamentos GLP-1 y ahora es director ejecutivo de SixPeaks Bio, una empresa emergente enfocada en la obesidad en Basilea, Suiza.
El auge en el desarrollo de fármacos contra la obesidad ha sido posible gracias al éxito rotundo de la semaglutida y su fármaco rival, la tirzepatida (que se comercializa como Zepbound o Mounjaro). Estos fármacos han abierto el potencial de un mercado global que, según las proyecciones, superará los 100.000 millones de dólares para finales de la década.
Sin embargo, la semaglutida y la tirzepatida tienen limitaciones. Requieren inyecciones semanales y suelen causar efectos secundarios desagradables, siendo especialmente comunes las náuseas , los vómitos y la diarrea. A largo plazo, la pérdida de masa muscular y la probabilidad de recuperar el peso después de interrumpir el tratamiento también son problemas. Además, los medicamentos no funcionan lo suficiente en un 10-30% de las personas que los toman.
Las terapias emergentes tienen como objetivo amplificar la pérdida de peso, mejorar la tolerabilidad, garantizar efectos duraderos y encontrar opciones para una gama más amplia de personas (ver 'El próximo paso en los medicamentos contra la obesidad'). "Vamos a ver que hay diferentes medicamentos que funcionan mejor para diferentes grupos de personas", dice Louis Aronne, un especialista en obesidad de Weill Cornell Medicine en la ciudad de Nueva York que asesora a los fabricantes de medicamentos.
El próximo paso en los medicamentos contra la obesidad
Fechas previstas de aprobación en EE.UU. de nuevos tipos de medicamentos para bajar de peso que llegarán al mercado.
Año estimado | Droga | Compañía | Descripción |
|---|---|---|---|
2026 | Orforglipron | Eli Lilly | Un fármaco oral de molécula pequeña que activa el receptor del péptido similar al glucagón 1 (GLP-1). |
2026 | CagriSema | Nuevo Nordisk | Un inyectable que activa los receptores de amilina y GLP-1. |
2027 | Survodutida | Boehringer Ingelheim | Un inyectable que activa los receptores de glucagón y GLP-1. |
2027 | Retatrutida | Eli Lilly | Un inyectable que activa los receptores de GLP-1, polipéptido inhibidor gástrico (GIP) y glucagón. |
2028 y más allá | Marítima | Amgen | Un inyectable que activa el receptor GLP-1 mientras bloquea la señalización de GIP. |
2028 y más allá | Bimagrumab | Eli Lilly | Un inyectable que bloquea los receptores implicados en la señalización de la miostatina. |
2028 y más allá | Monlunabant | Nuevo Nordisk | Un fármaco oral que inhibe el receptor cannabinoide CB1. |
Diversas rutas, misma búsqueda
La semaglutida y la tirzepatida suelen agruparse bajo el paraguas de los fármacos GLP-1, pero difieren en un aspecto clave: la tirzepatida no solo imita al GLP-1 sino también a una hormona complementaria llamada polipéptido inhibidor gástrico (GIP). Esta hormona acelera aún más el metabolismo energético y afecta la forma en que el cuerpo almacena y quema los nutrientes. Se cree que la doble acción de la tirzepatida contribuye a sus resultados superiores en la pérdida de peso.
En un gran ensayo comparativo, patrocinado por el fabricante de tirzepatida, Eli Lilly, en Indianápolis, Indiana, los participantes que tomaron tirzepatida perdieron una media del 20% de su peso corporal, superando la reducción del 14% conseguida con semaglutida, que es producida por la empresa farmacéutica Novo Nordisk en Bagsværd, Dinamarca. "Creemos que existe un mecanismo homeostático, como un termostato, que cada uno de nosotros tiene que está ajustado a un determinado peso corporal, y que impulsará el hambre hasta que lo alcancemos", afirma Dan Skovronsky, director científico de Eli Lilly. Pero, afirma, los fármacos como la tirzepatida pueden anular este mecanismo natural .
Inspiradas por el éxito de la tirzepatida, muchas empresas están desarrollando otros fármacos que se acoplan a los receptores GLP-1 y GIP. Al menos cinco terapias similares a la tirzepatida están en fase de ensayos clínicos, y se espera que la primera llegue al mercado en 2028. Tanto los pacientes como los médicos "necesitan una variedad de opciones", dice Ron Renaud, director ejecutivo de Kailera Therapeutics, una empresa emergente de biotecnología en Waltham, Massachusetts, que tiene una terapia similar a la tirzepatida en fase avanzada de ensayos clínicos.
Además de los activadores duales, como la tirzepatida, también existen fármacos candidatos como MariTide (producido por la empresa biofarmacéutica Amgen en Thousand Oaks, California) que, en cambio, bloquean la señalización de GIP mientras siguen activando el GLP-1. Puede parecer contradictorio que ambos enfoques puedan funcionar, pero Jonathan Campbell, un investigador del metabolismo de la Universidad Duke en Durham, Carolina del Norte, explica el metabolismo en términos del consumo de combustible de un vehículo en la autopista: pisar el acelerador a fondo, como ocurre con la activación de GIP, quema energía de manera ineficiente, agotando los recursos más rápido de lo que pueden reponerse. Por el contrario, conducir sin soltar completamente el freno de mano crea una fricción constante, muy similar al bloqueo de GIP, que introduce ineficiencias al obligar al sistema a trabajar más para mantener la velocidad.
“En términos de control de peso, cualquier cosa que te haga menos eficiente será positiva”, dice Campbell, quien recibe fondos de investigación de las compañías farmacéuticas. Pero advierte que las consecuencias más amplias de cada estrategia siguen siendo inciertas. Debido a que el GIP también juega un papel en la salud ósea, existe la preocupación de que bloquear la señalización de GIP pueda afectar negativamente a la salud ósea. También hay preguntas persistentes sobre los efectos a largo plazo de la pérdida drástica de peso en el resto del cuerpo, incluidos los músculos, la flexibilidad metabólica y la salud de los órganos.
Aunque se ha demostrado que medicamentos como la semaglutida y la tirzepatida reducen el riesgo de accidente cerebrovascular, ataque cardíaco y otros problemas cardiovasculares, además de aliviar la apnea del sueño y mejorar la función hepática , también se los ha vinculado con afecciones como la artritis y la pancreatitis . Los riesgos desconocidos, en particular en poblaciones diversas y con el uso prolongado, llevan a algunos médicos a favorecer soluciones quirúrgicas establecidas, como la cirugía bariátrica.
Pero la incertidumbre no ha disuadido a las compañías farmacéuticas de buscar una gama cada vez mayor de objetivos hormonales. Entre ellos se incluyen otras hormonas derivadas del intestino, como el péptido YY, conocido por su capacidad para hacer que uno se sienta saciado, y hormonas liberadas por el páncreas, como el glucagón y la amilina, que podrían complementar las terapias basadas en GLP-1 al aumentar el gasto energético, estabilizar los niveles de azúcar en sangre y suprimir aún más el apetito.
Trabajando juntos
Muchas estrategias en desarrollo se dirigen a múltiples vías simultáneamente. La terapia combinada CagriSema, por ejemplo, combina un análogo de amilina de acción prolongada con semaglutida. Los participantes en un ensayo de fase III de 68 semanas perdieron un promedio de casi el 23% de su peso corporal con este enfoque, según Novo Nordisk, la empresa que está detrás del medicamento.
Si los ensayos en curso tienen éxito, CagriSema, junto con agentes que combinan la actividad de GLP-1 y glucagón, como la survodutida de la empresa farmacéutica Boehringer Ingelheim en Ingelheim, Alemania, podrían obtener la aprobación regulatoria ya en 2026 o 2027. Sin embargo, su impacto podría verse eclipsado por otro contendiente. En la fase II de pruebas, la retatrutida de Eli Lilly, apodada "triple G" por su capacidad para dirigirse a los receptores de GLP-1, GIP y glucagón, produjo una reducción de peso promedio del 24% después de 48 semanas, estableciendo un nuevo punto de referencia para los tratamientos de la obesidad 1 (ver "Perder peso").
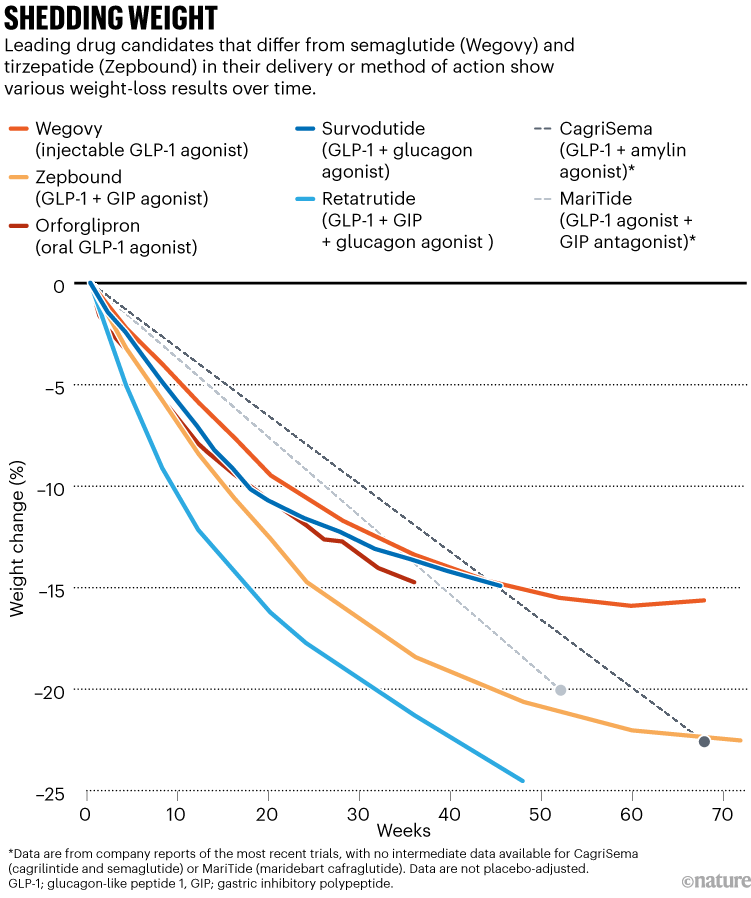
Fuentes: Weg.: JP-H. Wilding et al. N. Ing. J. Med . 384 , 989–1002 (2021); Zep.: AM Jastreboff et al. N. inglés. J. Med . 387 , 205–216 (2022); Supervivencia: CW le Roux et al. Lanceta Diabetes Endocrinol . 12 , 162-173 (2024); Reta.: ref. 1; Orf.: ref. 2; CagriSema: go.nature.com/4hmabvt ; MariTide: go.nature.com/41scez4
Carel le Roux, especialista en medicina metabólica del University College de Dublín que asesora a varias compañías farmacéuticas, afirma que los hallazgos sugieren que “cuantos más mecanismos añadimos, más beneficios obtenemos”. La activación de múltiples vías podría permitir dosis más bajas que logren la misma pérdida de peso con menos efectos secundarios.
Las empresas también están explorando alternativas a las inyecciones semanales, que pueden ser difíciles de incorporar a las rutinas de las personas y conllevan desafíos de fabricación. Se están desarrollando inyectables mensuales, pero las píldoras GLP-1, lideradas por un fármaco llamado orforglipron producido por Eli Lilly, podrían llegar primero y llegar al mercado el año que viene. En un estudio de fase II de 36 semanas, los participantes perdieron hasta el 15% de su peso corporal con la opción oral diaria2 .
Objetivos menos familiares
Aunque las hormonas intestinales siguen siendo la piedra angular del desarrollo de fármacos para la obesidad, la secuenciación genética a gran escala ha sido una fuente de inspiración para nuevos objetivos. En 2021, los científicos de la empresa de biotecnología Regeneron Pharmaceuticals en Tarrytown, Nueva York, dirigieron un análisis de ADN de casi 650.000 personas y descubrieron una variante genética rara relacionada con el bajo peso corporal 3 . Al año siguiente, los investigadores de Alnylam Pharmaceuticals en Cambridge, Massachusetts, dirigieron un estudio que identificó una mutación en un gen llamado INHBE . La mutación está asociada con una baja relación cintura-cadera, una medida que refleja una distribución de grasa más saludable en el cuerpo 4 . Las empresas ahora están tratando de desarrollar medicamentos que repliquen los beneficios metabólicos de estas variantes genéticas.
También se está prestando renovada atención a viejos objetivos. Un ejemplo es el receptor cannabinoide CB1, que se buscó originalmente después de que los investigadores descubrieran su papel en la estimulación del apetito inducida por la marihuana, comúnmente conocida como munchies. A fines de la década de 2000, un fármaco diseñado para contrarrestar este efecto se vendió brevemente en Europa como terapia para perder peso. Pero la inhibición de los receptores cannabinoides en el cerebro se asoció con un mayor riesgo de depresión, ansiedad y pensamientos suicidas en algunas personas. El fármaco, conocido como rimonabant, fue retirado del mercado después de menos de tres años, y las empresas rivales abandonaron candidatos similares.
Pero George Kunos, neuroendocrinólogo del Instituto Nacional sobre Abuso de Alcohol y Alcoholismo de Estados Unidos, en Bethesda, Maryland, nunca abandonó la estrategia de bloqueo de los cannabinoides. Hace unos 15 años, su equipo y otros demostraron en roedores que gran parte de los efectos antiobesidad de los inhibidores CB1 provenían de vías metabólicas en el hígado, los músculos, el páncreas y otros órganos fuera del cerebro. Si un fármaco como el rimonabant pudiera modificarse químicamente para evitar que cruzara la barrera hematoencefálica, podría ofrecer beneficios metabólicos sin los graves efectos secundarios.
El laboratorio de Kunos creó un bloqueador de cannabinoides de nueva generación, conocido ahora como monlunabant y desarrollado por Novo Nordisk. El año pasado, los resultados de los ensayos de fase II indicaron que el monlunabant todavía puede causar ansiedad, irritabilidad y trastornos del sueño. Aun así, Kunos predice que los fabricantes del fármaco "llegarán a una dosis que provoque una reducción de peso significativa con niveles aceptables de efectos secundarios".
Gran flexión
Se están explorando otras tácticas terapéuticas. Por ejemplo, un agente que bloquea la absorción de alimentos en los intestinos y otro que inhibe una enzima que metaboliza la grasa se encuentran en ensayos de fase II. Pero las terapias dirigidas a los músculos, como el bimagrumab, son las que están despertando el mayor interés de la industria, en gran parte porque alrededor de un tercio de la reducción de peso en las personas que toman semaglutida o tirzepatida se debe a la pérdida de músculo, no de grasa.
La pérdida de masa muscular plantea problemas estéticos y puede reducir la fuerza, la movilidad y la salud fisiológica general. El músculo también tiene un papel crucial en la regulación de la glucosa y el gasto energético. Por lo tanto, la pérdida de masa muscular es “un impedimento importante para una pérdida de peso continua y sostenible”, afirma Melanie Haines, endocrinóloga del Hospital General de Massachusetts en Boston que estudia el bimagrumab.

Los medicamentos orales contra la obesidad podrían ser una alternativa a los tratamientos inyectables que se administran una vez por semana. Crédito: Joe Buglewicz para The Washington Post/Getty
A las personas que toman fármacos GLP-1 se les aconseja ahora que consuman alimentos ricos en proteínas y que realicen entrenamiento de resistencia para preservar la masa muscular. Pero un fármaco dirigido a la señalización de la miostatina (el principal freno molecular del crecimiento muscular) podría ofrecer una solución más práctica y potente, afirma Se-Jin Lee, biólogo muscular del Laboratorio Jackson de Medicina Genómica en Farmington, Connecticut. Lee, que descubrió la miostatina en la década de 1990, es consultor de varias compañías farmacéuticas.
El fármaco experimental que tomó Cook, bimagrumab, funciona de la misma manera: bloquea un receptor a través del cual la miostatina y las proteínas relacionadas inhiben el crecimiento muscular y promueven la retención de grasa. Después de tomar la terapia junto con semaglutida durante casi un año, Cook perdió casi 18 kilogramos de grasa mientras ganaba un kilogramo de músculo. La principal desventaja, dice, fue que experimentó calambres y espasmos esporádicos, en la ingle, el hombro e incluso en los músculos de la parte posterior de la lengua.
Ahora que ha dejado de tomar medicamentos por completo, Cook ha recuperado algo de grasa, pero sigue estando más de un 10 % por debajo de su peso máximo y su masa muscular se ha mantenido relativamente estable. “Para mí, fue una experiencia que cambió mi vida”, afirma Cook.
El bimagrumab comenzó como un fármaco candidato para la pérdida muscular relacionada con la edad y otras afecciones que agotan los músculos. Los ensayos muestran que aumenta la masa muscular sin mayores problemas de seguridad, pero el fármaco no demostró ser mejor que un placebo en pruebas funcionales de fuerza de agarre y capacidad para caminar. Novartis, una empresa farmacéutica de Basilea, Suiza, interrumpió el desarrollo del fármaco en 2017.
Aun así, dos altos ejecutivos de Novartis se mantuvieron firmes en su confianza en el bimagrumab, que mejoró las medidas de control del azúcar en sangre y mostró ser prometedor para reducir la grasa en pequeños ensayos con personas en riesgo de padecer diabetes tipo 2 o que ya la padecían. El fármaco era "muy potente y, en realidad, bastante seguro", afirma Mark Fishman, expresidente de investigación biomédica de Novartis. Su equipo solo necesitaba encontrar la razón correcta para usarlo.
Fishman ahora está en la Universidad de Harvard en Cambridge y dirige el consejo asesor científico de Aditum Bio, una empresa de inversiones en Oakland, California, que cofundó con el ex director ejecutivo de Novartis, Joe Jiménez. En 2021, Aditum ayudó a lanzar una empresa centrada en reposicionar el bimagrumab como una solución para bajar de peso. (Esa start-up fue adquirida posteriormente por Eli Lilly, que aún no ha publicado los resultados del ensayo con 500 personas, ya finalizado, al que se unió Cook).
Otras compañías están siguiendo el ejemplo del bimagrumab, resucitando terapias dirigidas a los músculos que se habían dejado de lado y que originalmente se desarrollaron para afecciones no relacionadas con la pérdida de peso, y explorando nuevos mecanismos para promover el crecimiento muscular y la salud metabólica. “Todo el mundo quiere desempolvar sus compuestos de miostatina para ver si pueden reutilizarlos para el panorama de la obesidad”, dice Paul Titchenell, investigador del metabolismo molecular en la Facultad de Medicina Perelman de la Universidad de Pensilvania en Filadelfia.
Aún no se sabe con certeza qué importancia tendrá la conservación de la masa muscular para el control del peso a largo plazo. Según los registros sanitarios y las reclamaciones a las compañías de seguros de Estados Unidos, la mayoría de las personas que empiezan a tomar semaglutida o tirzepatida para adelgazar acaban abandonando el tratamiento al cabo de uno o dos años, lo que provoca un rebote del peso, que se recupera en su mayor parte en forma de grasa.
Si se repite ese ciclo varias veces, a medida que la gente toma y deja de tomar medicamentos para bajar de peso, la pérdida acumulada de músculo podría tener consecuencias duraderas. “Podríamos estar creando una generación de personas con sarcopenia”, dice Carla Prado, investigadora de nutrición de la Universidad de Alberta en Edmonton, Canadá, utilizando el término médico para una afección caracterizada por una pérdida progresiva de masa y fuerza muscular.
Pero por ahora, dice Caterina Conte, especialista en obesidad de la Universidad San Raffaele Roma de Roma, “la evidencia no respalda esta preocupación” (Prado y Conte publicaron comentarios opuestos el año pasado en los que debatían el papel de la preservación muscular en los tratamientos de la obesidad 5 , 6 ).
Muchos defensores de las terapias dirigidas a los músculos reconocen las incertidumbres. “Estamos adentrándonos en un territorio que realmente no se ha estudiado antes”, dice Steven Heymsfield, un especialista en obesidad del Centro de Investigación Biomédica Pennington en Baton Rouge, Louisiana, que ha participado en ensayos con bimagrumab y otros medicamentos para bajar de peso. De cualquier manera, Heymsfield y otros esperan que los agentes dirigidos a los músculos se conviertan en parte de una farmacopea diversa para tratar a las personas con obesidad y problemas de salud relacionados.
La semaglutida y la tirzepatida no se mantendrán solas por mucho tiempo, señala Boaz Hirshberg, vicepresidente sénior y director de la unidad de desarrollo clínico de medicina interna de Regeneron, que está desarrollando terapias dirigidas a los músculos. A medida que surjan otras opciones, afirma, "podemos empezar a pensar en cómo adaptar el tratamiento en función de las necesidades de los pacientes".
Fuente: Nature
Referencias
1. Jastreboff, A. M. et al. N. Engl. J. Med. 389, 514–526 (2023). Artículo
2. Wharton, S. et al. N. Engl. J. Med. 389, 877–888 (2023). Artículo
3. Akbari, P. et al. Science 373, eabf8683 (2021). Artículo
4. Deaton, A. M. et al. Nature Commun. 13, 4319 (2022). Artículo
5. Prado, C. M., Phillips, S. M., Gonzalez, M. C. & Heymsfield, S. B. Lancet Diabetes Endocrinol. 12, 785–787 (2024). Artículo
6. Conte, C., Hall, K. D. & Klein, S. JAMA 332, 9–10 (2024). Artículo




















COMENTARIOS